#PCOS-2
1 เดือนที่ผ่านมา
โดย เจ้าของร้าน
#PCOS-2
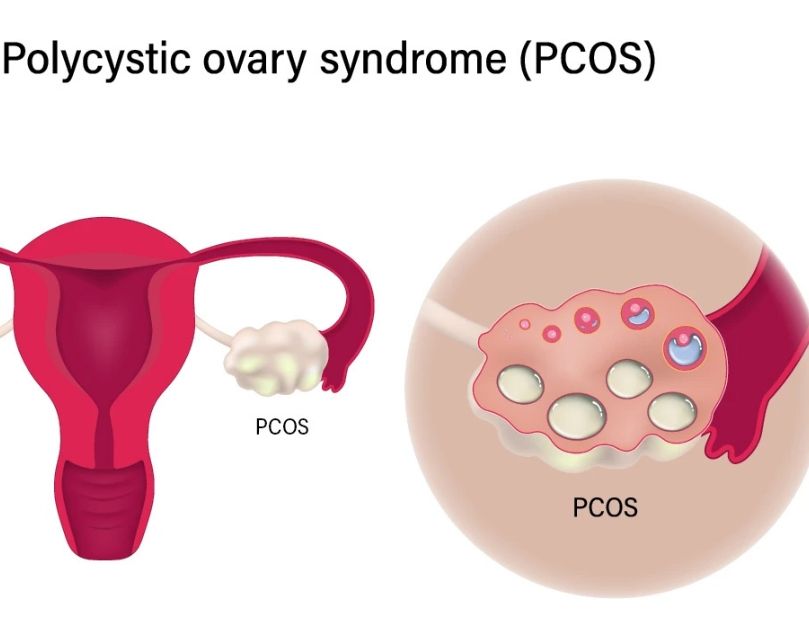
กลุ่มอาการถุงน้ำรังไข่หลายใบ (PCOS) เป็นโรคต่อมไร้ท่อที่พบบ่อยที่สุดในสตรีวัยเจริญพันธุ์ ซึ่งนำไปสู่ความผิดปกติของประจำเดือนและภาวะมีบุตรยาก การกำเนิดของ PCOS มีความซับซ้อนและยังไม่ได้รับการอธิบายอย่างชัดเจน จุลินทรีย์ในลำไส้เกี่ยวข้องกับความผิดปกติของการเผาผลาญไขมัน กลูโคส และฮอร์โมนสเตียรอยด์
การศึกษาจำนวนมากแสดงให้เห็นว่าจุลินทรีย์ในลำไส้สามารถควบคุมการสังเคราะห์และการหลั่งอินซูลิน และส่งผลต่อการเผาผลาญแอนโดรเจนและการพัฒนาของฟอลลิเคิล ซึ่งทำให้เรามีแนวคิดใหม่ในการไขความกระจ่างเกี่ยวกับการกำเนิดของ PCOS ความสัมพันธ์ระหว่างจุลินทรีย์ในลำไส้และการกำเนิดของ PCOS มีความสำคัญอย่างยิ่ง การศึกษานี้ได้ทบทวนความก้าวหน้าทางการวิจัยล่าสุดเกี่ยวกับบทบาทของจุลินทรีย์ในลำไส้ต่อการเกิดและการพัฒนาของ PCOS คาดว่าจะเป็นแนวทางใหม่ในการรักษา PCOS โดยอาศัยจุลินทรีย์ในลำไส้
PCOS เป็นโรคต่อมไร้ท่อที่พบบ่อยที่สุด โดยมีสาเหตุและพยาธิกำเนิดที่ซับซ้อน (Glintborg และ Andersen, 2010) ในสตรีวัยเจริญพันธุ์ อัตราการเกิด PCOS สูงถึง 5%-10% คิดเป็น 50%-70% ของภาวะมีบุตรยากแบบไม่มีไข่ตก (Anonus and Pate, 2013) PCOS มีลักษณะเด่นหลักคือการหลั่งฮอร์โมนแอนโดรเจนมากเกินไป ความผิดปกติของการตกไข่ และการเปลี่ยนแปลงของรังไข่ที่มีถุงน้ำจำนวนมาก และอาจมาพร้อมกับภาวะอ้วนลงพุง ภาวะดื้อต่ออินซูลิน การเผาผลาญกลูโคสบกพร่อง และภาวะไขมันในเลือดผิดปกติ (Froment et al., 2022) ภาวะแทรกซ้อนระยะสั้นของโรคนี้ ได้แก่ ภาวะมีบุตรยาก การแท้งบุตร การคลอดก่อนกำหนด และผลลัพธ์ที่ไม่พึงประสงค์อื่นๆ ของการตั้งครรภ์ ซึ่งอาจเพิ่มความเสี่ยงต่อโรคเบาหวาน โรคหลอดเลือดหัวใจ มะเร็งเยื่อบุโพรงมดลูก และโรคอื่นๆ ในระยะยาว (Hirschberg, 2009) ในปัจจุบัน นักวิชาการส่วนใหญ่เชื่อว่า PCOS เป็นโรคที่ควบคุมโดยยีนหลายชนิดและถูกกระตุ้นด้วยปัจจัยหลายประการ การเกิดโรคของ PCOS ยังไม่ชัดเจน และผลการรักษาทางคลินิกของผู้ป่วยหลายรายยังไม่ชัดเจน
ลำไส้ของมนุษย์มีจุลินทรีย์อยู่มากมาย จุลินทรีย์ในลำไส้และสิ่งมีชีวิตที่อาศัยอยู่ร่วมกันตลอดชีวิตและเป็นประโยชน์ร่วมกัน จุลินทรีย์ในลำไส้กลายเป็นประเด็นสำคัญในการวิจัยเกี่ยวกับโรคมะเร็ง โรคภูมิคุ้มกัน และโรคเมแทบอลิซึม (Hu et al., 2020; Zhao CJ. et al., 2022; Zhao MK. et al., 2022) ในช่วงไม่กี่ปีที่ผ่านมา ยังมีรายงานการวิจัยเกี่ยวกับจุลินทรีย์ในลำไส้ของผู้ป่วย PCOS และความสัมพันธ์กับความผิดปกติของเมแทบอลิซึม (Siddiqui et al., 2022)
การศึกษาแสดงให้เห็นว่าจุลินทรีย์ในลำไส้ของผู้ป่วย PCOS เกี่ยวข้องกับการเกิดและการพัฒนาของภาวะดื้อต่ออินซูลิน ภาวะแอนโดรเจนในเลือดสูง การอักเสบเรื้อรัง และกลุ่มอาการเมตาบอลิก และอาจส่งผลต่ออาการทางคลินิกของ PCOS ผ่านทางกรดไขมันสายสั้น ไลโปโพลีแซ็กคาไรด์ ฮอร์โมนเพศ และแกนสมอง-ลำไส้ (Gu et al., 2022; Zhang et al., 2022) นอกจากนี้ การศึกษาทางคลินิกจำนวนหนึ่งได้พยายามใช้การปลูกถ่ายจุลินทรีย์ในอุจจาระ การเสริมโปรไบโอติก และการแพทย์แผนจีนเพื่อควบคุมจุลินทรีย์ในลำไส้และสำรวจความเป็นไปได้ในการรักษาโรคบางชนิด (Quaranta et al., 2019)
การเปลี่ยนแปลงองค์ประกอบของจุลินทรีย์ในลำไส้ใน PCOS
องค์ประกอบของจุลินทรีย์ในลำไส้ของมนุษย์มีความซับซ้อน มีงานวิจัยจำนวนมากขึ้นเรื่อยๆ ที่แสดงให้เห็นว่าจุลินทรีย์ในลำไส้มีความสัมพันธ์อย่างใกล้ชิดกับการเผาผลาญกลูโคสและไขมัน (Roessler et al., 2022) เมื่อเปรียบเทียบกับคนปกติ องค์ประกอบของจุลินทรีย์ในลำไส้ในคนอ้วน เบาหวานชนิดที่ 2 และคนทั่วไปจะเปลี่ยนแปลงไป และจุลินทรีย์ที่แตกต่างกันอาจมีส่วนร่วมในการตอบสนองต่อการอักเสบ ส่งผลต่อเสถียรภาพของเยื่อบุลำไส้ และปรับปรุงการเผาผลาญ (Moser et al., 2022; Sugawara et al., 2022) การศึกษาหลายชิ้นแสดงให้เห็นว่าจุลินทรีย์ในลำไส้มีบทบาทสำคัญในการเกิดและการพัฒนาของ PCOS (Duan et al., 2021) การศึกษาก่อนหน้านี้พบว่าแบคทีเรียในลำไส้ Bacteroides ลดลง และแบคทีเรีย Firmicus และ Proteus เพิ่มขึ้นในหนูที่ได้รับ dehydroepiandrosterone/อาหารไขมันสูง ซึ่งเป็นสาเหตุของ PCOS การวิเคราะห์ความสัมพันธ์แสดงให้เห็นว่าระดับของปัจจัยการอักเสบในหนูมีความสัมพันธ์กับความอุดมสมบูรณ์ของจุลินทรีย์ในลำไส้ (Lin et al., 2021) เมื่อเปรียบเทียบกับกลุ่มควบคุมที่มีสุขภาพดี หนูที่ได้รับเลโทรโซลที่เหนี่ยวนำให้เกิด PCOS มีแลคโตบาซิลลัส รูเมนค็อกคัส และคลอสตริเดียมในลำไส้น้อยกว่า และมีพุลลอรัมมากกว่า (Zhao HY. et al., 2022) เมื่อเปรียบเทียบกับคนที่มีสุขภาพดี ความหลากหลายของจุลินทรีย์ในลำไส้ของผู้ป่วย PCOS ลดลง องค์ประกอบเปลี่ยนไป และเยื่อเมือกในลำไส้ได้รับความเสียหาย (Lindheim et al., 2017) เมื่อเปรียบเทียบกับผู้ป่วย PCOS ที่ไม่อ้วนและกลุ่มควบคุมที่มีสุขภาพดี ผู้ป่วย PCOS ที่เป็นโรคอ้วนมีเอนเทอโรแบคทีเรียเพิ่มขึ้น แลคโตบาซิลลัสและบิฟิโดแบคทีเรียลดลง และการเปลี่ยนแปลงของจุลินทรีย์ในลำไส้มีความสัมพันธ์กับระดับการอักเสบและภาวะดื้อต่ออินซูลิน (Zhou et al., 2020) Zeng et al. ชี้ให้เห็นว่ามีความแตกต่างในองค์ประกอบและโครงสร้างของจุลินทรีย์ในลำไส้ในผู้ป่วย PCOS ที่มีหรือไม่มีภาวะดื้อต่ออินซูลิน (Zeng et al., 2019) การศึกษาเหล่านี้แสดงให้เห็นว่าความหลากหลายของจุลินทรีย์ในลำไส้และความอุดมสมบูรณ์ของจุลินทรีย์ที่เกี่ยวข้องในผู้ป่วย PCOS มีการเปลี่ยนแปลง จุลินทรีย์ในลำไส้อาจเปลี่ยนแปลงความเสถียรของเยื่อบุลำไส้ และส่งผลต่อการเผาผลาญอาหารโดยมีส่วนร่วมในการเกิดปฏิกิริยาการอักเสบในผู้ป่วย PCOS (Zeng et al., 2019)
จุลินทรีย์ในลำไส้และกลไกทางพยาธิวิทยาของ POCS
จุลินทรีย์ในลำไส้เป็น "อวัยวะต่อมไร้ท่อ" ที่ช่วยรักษาสุขภาพของมนุษย์ จุลินทรีย์ในลำไส้ส่งผลต่อระบบต่อมไร้ท่อสืบพันธุ์โดยทำปฏิกิริยากับเอสโตรเจน แอนโดรเจน อินซูลิน ฯลฯ (Qi et al., 2021) ลักษณะทั่วไปของ PCOS ได้แก่ ระดับฮอร์โมนเพศที่ผิดปกติ ภาวะดื้อต่ออินซูลิน การเปลี่ยนแปลงของถุงน้ำจำนวนมากในรังไข่ การอักเสบเรื้อรังแบบไม่แสดงอาการ ฯลฯ (Szukiewicz et al., 2022) ความผิดปกติของจุลินทรีย์ในลำไส้เกี่ยวข้องกับภาวะเอนโดท็อกซีเมีย การผลิต SCFA การเผาผลาญกรดน้ำดี การหลั่งเปปไทด์ในลำไส้ผิดปกติ เป็นต้น กระบวนการทางสรีรวิทยาและพยาธิวิทยาข้างต้นเกี่ยวข้องกับอาการของ PCOS เช่น ภาวะแอนโดรเจนสูงเกินปกติ ภาวะดื้อต่ออินซูลิน ปฏิกิริยาอักเสบเรื้อรัง และระดับเปปไทด์ในลำไส้ผิดปกติ (Li MW. et al., 2022) ดังนั้น จุลินทรีย์ในลำไส้อาจส่งผลต่อการพัฒนาของฟอลลิเคิล ฮอร์โมนเพศ และระดับเมแทบอลิซึมผ่านภาวะแอนโดรเจนสูงเกินปกติ ภาวะดื้อต่ออินซูลิน การอักเสบเรื้อรัง แกนสมอง-ลำไส้ ฯลฯ และมีส่วนทำให้เกิดโรค PCOS
จุลินทรีย์ในลำไส้และภาวะดื้อต่ออินซูลิน
ภาวะดื้อต่ออินซูลินเป็นหนึ่งในลักษณะทางต่อมไร้ท่อที่พบบ่อยที่สุดในผู้ป่วย PCOS (Petrillo et al., 2022) ผู้ป่วย PCOS ประมาณ 50%-70% มีภาวะดื้อต่ออินซูลินในระดับที่แตกต่างกัน โดยเฉพาะในผู้ป่วยโรคอ้วน ความเสี่ยงต่อโรคเบาหวานในผู้ป่วย PCOS สูงกว่าในผู้หญิงปกติ ภาวะดื้ออินซูลินและโรคอ้วนสามารถทำให้ความผิดปกติของการเผาผลาญกลูโคส ไขมัน และระดับแอนโดรเจนในเลือดสูงในผู้ป่วย PCOS รุนแรงขึ้น (Amisi, 2022) การศึกษาแสดงให้เห็นว่าการเพิ่มปริมาณใยอาหารและการรับประทานอาหารเสริมบิวทิเรตสามารถป้องกันโรคอ้วนและปรับปรุงความไวต่ออินซูลินได้ (Mayorga-Ramos et al., 2022) ความไม่สมดุลของจุลินทรีย์ในลำไส้สามารถเปลี่ยนแปลงปริมาณของ SCFAs ได้ โดยเฉพาะอย่างยิ่งในผู้ป่วย PCOS ที่มีภาวะดื้ออินซูลิน
การศึกษาแสดงให้เห็นว่าการเกิดภาวะดื้ออินซูลินมีความสัมพันธ์อย่างใกล้ชิดกับความผิดปกติของจุลินทรีย์ในลำไส้ (Martinez-Montoro et al., 2022) Zeng et al. ได้เปรียบเทียบจุลินทรีย์ในลำไส้ของผู้ป่วย PCOS ที่มีภาวะดื้ออินซูลินกับกลุ่มควบคุมที่มีสุขภาพดี และพบว่าปริมาณ Prevotella ลดลงและ Bacteroides เพิ่มขึ้นในกลุ่มแรก (Zeng et al., 2019) จุลินทรีย์ในลำไส้อาจส่งผลต่อการเผาผลาญกรดน้ำดีและนำไปสู่ภาวะดื้ออินซูลิน การศึกษาแสดงให้เห็นว่าปริมาณ Bacteroides ทั่วไปในจุลินทรีย์ในลำไส้ของผู้ป่วย PCOS เพิ่มขึ้นอย่างมีนัยสำคัญ ซึ่งอาจเกิดจากการลดลงของ IL-22, การดื้อต่ออินซูลิน และในที่สุดก็คือ PCOS โดยส่งผลต่อระดับการสังเคราะห์กรดน้ำดี (Qi X. et al., 2019; Qi et al., 2020)
จุลินทรีย์ในลำไส้และภาวะแอนโดรเจนเกินปกติ
ภาวะแอนโดรเจนเกินปกติมีบทบาทสำคัญทางพยาธิสรีรวิทยาในการเกิดโรค PCOS (Witchel et al., 2022) อาการทางคลินิกที่พบบ่อยคือ ขนดก และสิว การศึกษาแสดงให้เห็นว่าภาวะแอนโดรเจนเกินปกติเกี่ยวข้องกับจุลินทรีย์ในลำไส้ (Torres et al., 2019) Zhang et al. พบว่าหนู PCOS ที่ถูกเหนี่ยวนำโดย dihydrotestosterone มีจำนวนเชื้อคลามีเดียเพิ่มขึ้น แต่จำนวนเชื้อ Escherichia coli ลดลง และส่งผลต่อมวลร่างกายและมวลไขมัน ซึ่งชี้ให้เห็นว่าจุลินทรีย์ในลำไส้เกี่ยวข้องกับระดับของภาวะแอนโดรเจนเกินปกติในหนู (Zhang et al., 2019) Chu et al. พบว่าหลังจากย้ายจุลินทรีย์ในลำไส้ของหนูตัวผู้ไปยังหนูตัวเมีย พบว่าเมแทบอลิซึมพื้นฐานของหนูตัวเมียผิดปกติ และระดับเทสโทสเตอโรนของหนูในสภาพแวดล้อมที่มีแบคทีเรียสูงกว่าหนูในสภาพแวดล้อมที่ปลอดเชื้อ สิ่งนี้บ่งชี้ว่าจุลินทรีย์ในลำไส้ส่งผลต่อการหลั่งฮอร์โมนเทสโทสเตอโรนในร่างกาย Markle และคณะ แสดงให้เห็นว่าภาวะแอนโดรเจนในเลือดสูงอาจทำให้เกิดภาวะดื้อต่ออินซูลินและความผิดปกติของระบบเผาผลาญของ PCOS โดยทำให้แบคทีเรียในลำไส้มีปริมาณเพิ่มขึ้น (Markle, 2001) Kelley และคณะ พบว่าความหลากหลายของจุลินทรีย์ในลำไส้ลดลงในหนูทดลอง Kaohsiung PCOS ที่เกิดจาก Trazole (Kelley และคณะ, 2016) Barroso และคณะ พบว่าความหลากหลายของจุลินทรีย์ในลำไส้ของหนูตัวเมียที่สัมผัสกับสภาพแวดล้อมที่มีระดับแอนโดรเจนสูงภายใน 24 ชั่วโมงหลังคลอดลดลง และความเสี่ยงต่อการเกิดโรคเมตาบอลิซึมในลูกหนูที่โตเต็มวัยเพิ่มขึ้น ซึ่งบ่งชี้ว่าการสัมผัสแอนโดรเจนในระยะแรกของลูกหนูตัวเมียที่มี PCOS อาจนำไปสู่การเปลี่ยนแปลงระยะยาวในจุลินทรีย์ในลำไส้และการทำงานของระบบเผาผลาญ (Barroso และคณะ, 2020)
จุลินทรีย์ในลำไส้และการอักเสบเรื้อรัง
ภาวะลำไส้รั่ว หมายถึงความผิดปกติของเยื่อบุลำไส้ และมีรายงานว่าเกี่ยวข้องกับโรคหลายชนิด ความผิดปกติของจุลินทรีย์ในลำไส้อาจนำไปสู่ภาวะลำไส้รั่ว แบคทีเรีย Bacteroides และ Escherichia coli ในลำไส้ของมนุษย์จัดอยู่ในกลุ่มแบคทีเรียแกรมลบ LPS เป็นองค์ประกอบสำคัญของผนังเซลล์ของแบคทีเรียแกรมลบ การศึกษาหลายชิ้นชี้ให้เห็นว่าการดูดซึม LPS ที่เพิ่มขึ้นจากลำไส้รั่วได้รับการเสนอแนะ หลังจากการบาดเจ็บของเยื่อบุลำไส้ LPS จะเข้าสู่ระบบไหลเวียนโลหิตและก่อให้เกิดภาวะเอนโดท็อกซีเมีย ผ่านทางโปรตีนจับ LPS (LBP), CD14 และปัจจัยการสร้างความแตกต่างของไขกระดูก-2 (MD-2) LPS ถูกตรวจพบและจับโดย TLR4 (Page et al., 2022) LPS สามารถกระตุ้นการแสดงออกของไซโตไคน์ที่ก่อให้เกิดการอักเสบและตัวกลางการอักเสบ การแสดงออกของปัจจัยที่ก่อให้เกิดการอักเสบ เช่น อินเตอร์ลิวคิน 6 (IL-6) และอินเตอร์ลิวคิน 6 (IL-6) สามารถกระตุ้นการตอบสนองของการอักเสบได้ ภาวะดื้อต่ออินซูลินถือเป็นแกนหลักของความผิดปกติของระบบเผาผลาญในผู้ป่วย PCOS ซึ่งส่งเสริมภาวะอักเสบเรื้อรังในผู้ป่วย PCOS (Dahan et al., 2022) มีการศึกษาว่าหนูทั้งสองกลุ่มได้รับอาหารปกติและอาหารไขมันสูงตามลำดับ หลังจาก 4 สัปดาห์ หนูที่ได้รับอาหารไขมันสูงมีภาวะอ้วนและแสดงอาการดื้อต่ออินซูลิน ความเข้มข้นของ LPS ในเลือดของหนูในกลุ่มที่ได้รับอาหารไขมันสูงสูงกว่ากลุ่มควบคุม 2-3 เท่า หนูในกลุ่มควบคุมได้รับ LPS ใต้ผิวหนัง หลังจาก 4 สัปดาห์ หนูในกลุ่มควบคุมมีภาวะอ้วนและแสดงอาการดื้อต่ออินซูลิน (Fang et al., 2022)
ผู้ป่วย PCOS แสดงภาวะอักเสบเรื้อรัง (Escobar-Morreale et al., 2011)
แมคโครฟาจเป็นหนึ่งในเซลล์ที่เกี่ยวข้องกับการควบคุมการอักเสบ สามารถพบแมคโครฟาจจำนวนมากแทรกซึมเข้าไปในเนื้อเยื่อรังไข่ของผู้ป่วย PCOS (Tedesco et al., 2019) นอกจากนี้ ปัจจัยการอักเสบหลักในเลือดส่วนปลายของผู้ป่วย PCOS เช่น TNF-α, C-reactive protein, IL-1, IL-6 เพิ่มขึ้นในระดับที่แตกต่างกัน การศึกษาอื่นๆ แสดงให้เห็นว่าจำนวนเซลล์ T helper ในผู้ป่วย PCOS สูงกว่าในผู้หญิงปกติ (Yang et al., 2021) ภายใต้การกระตุ้นของปัจจัยการอักเสบ เช่น IL-6 เซลล์ T helper 17 สามารถหลั่งปัจจัยที่ก่อให้เกิดการอักเสบ กระตุ้นให้เกิดภาวะอักเสบของร่างกาย และนำไปสู่ผลลัพธ์ที่ไม่พึงประสงค์ของภาวะแอนโดรเจนในเลือดสูงเกินไป ภาวะดื้อต่ออินซูลิน และความผิดปกติของการตกไข่ (Nasri et al., 2018) วอดส์เวิร์ธเทียในวงศ์บิโลฟิลาเป็นเชื้อก่อโรคที่เกี่ยวข้องกับระยะเริ่มต้นของการตอบสนองต่อการอักเสบ และมีความสัมพันธ์อย่างใกล้ชิดกับการเกิดโรคอักเสบหลายชนิด (Burrichter et al., 2021) จุลินทรีย์ในลำไส้ของหนูปลอดเชื้อที่ได้รับการปลูกถ่ายแบคทีเรียในอุจจาระจากผู้ป่วย PCOS ตรวจพบโดยเทคโนโลยีการจัดลำดับ 16s rDNA พบว่าระดับของวอดส์เวิร์ธเทียในหนูที่ได้รับการปลูกถ่ายแบคทีเรียในอุจจาระจากผู้ป่วย PCOS สูงกว่าในหนูที่ได้รับการปลูกถ่ายแบคทีเรียในอุจจาระที่แข็งแรง ซึ่งชี้ให้เห็นว่าวอดส์เวิร์ธเทียอาจมีส่วนร่วมในการก่อโรค PCOS ผ่านกระบวนการอักเสบ Qi et al. พบว่าปริมาณของ B. vulgatus ในลำไส้ของผู้ป่วย PCOS เพิ่มขึ้น ระดับกรดน้ำดี กรด tauroursodeoxycholic และกรด glycodeoxycholic ซึ่งเป็นสารเมตาบอไลต์ของแบคทีเรียในลำไส้ลดลง และระดับของปัจจัยภูมิคุ้มกันในลำไส้ IL-22 ก็ลดลงเช่นกัน (Qi XY. et al., 2019)
แกนสมอง-ลำไส้และ POCS
แกนสมอง-ลำไส้เป็นระบบแลกเปลี่ยนข้อมูลระหว่างสมองและลำไส้ (Hosie et al., 2022) เป็นเครือข่ายภูมิคุ้มกันระบบประสาทต่อมไร้ท่อที่ก่อตัวขึ้นจากระบบประสาทส่วนกลาง ระบบประสาทลำไส้ แกนไฮโปทาลามัส ต่อมใต้สมอง ต่อมหมวกไต และลำไส้ การเผาผลาญจุลินทรีย์ในลำไส้ที่ผิดปกติจะนำไปสู่การหลั่งเอนโดเปปไทด์ ไซโตไคน์ และปัจจัยการอักเสบในลำไส้ที่ผิดปกติ (Begum et al., 2022)
ฮอร์โมนในระบบทางเดินอาหารหลายชนิดมีปฏิกิริยากับแกนสมอง-ลำไส้ (Yin et al., 2022) การศึกษาแสดงให้เห็นว่าการหลั่งฮอร์โมนในระบบทางเดินอาหารในผู้ป่วย PCOS มีความผิดปกติ และระดับ GLP-1 ต่ำกว่าปกติ (Bednarz et al., 2022) มันสามารถชะลอการระบายของเสียในกระเพาะอาหาร ควบคุมความอยากอาหาร ลดมวลร่างกาย และส่งเสริมการเพิ่มจำนวนของเซลล์เบต้าในตับอ่อนและการกระตุ้นการหลั่งอินซูลิน ซึ่งมีบทบาทสำคัญในการทำงานที่หลากหลาย (Cena et al., 2020) ดังนั้น แกนสมอง-ลำไส้อาจเป็นเป้าหมายใหม่สำหรับการบำบัดภาวะดื้ออินซูลินในผู้ป่วย PCOS ในอนาคต
กลไกทางพยาธิวิทยาของ PCOS ไม่เพียงแต่จำกัดอยู่เพียงความผิดปกติของแกนรังไข่ต่อมใต้สมองไฮโปทาลามัสเท่านั้น แต่ยังเกี่ยวข้องกับแกนสมอง-ลำไส้ด้วย (Liang et al., 2021)
แกนสมอง-ลำไส้เป็นเส้นทางการส่งสัญญาณแบบสองเฟส ลำไส้และสมองเชื่อมต่อกันอย่างใกล้ชิดผ่านแกนสมอง-ลำไส้ แกนสมอง-ลำไส้มีบทบาทสำคัญในระบบแลกเปลี่ยนข้อมูล (Li et al., 2023) มีระบบการสื่อสารสองทางที่ซับซ้อนระหว่างระบบประสาทส่วนกลางและระบบทางเดินอาหาร (Xu et al., 2022) จุลินทรีย์ในลำไส้สามารถส่งผลกระทบต่อแกนสมอง-ลำไส้ได้หลายวิธี จุลินทรีย์ในลำไส้สามารถกระตุ้นเส้นทางประสาทเวกัสโดยตรงเพื่อส่งสัญญาณไปยังสมอง ข้อมูลที่ซับซ้อนต่างๆ ในลำไส้สามารถส่งผ่านไปยังสมองผ่านไซแนปส์ที่เกิดจากกลุ่มประสาทไมเอนเทอริกของปลายประสาทที่ส่งออกและเซลล์ประสาทหลังปมประสาท (Wang et al., 2023) ในเวลาเดียวกัน จุลินทรีย์ในลำไส้จะสร้างผลป้อนกลับไปยังสมองโดยการสังเคราะห์ฮอร์โมนและสารสื่อประสาท ตัวอย่างเช่น เปปไทด์ในลำไส้ในระบบไหลเวียนโลหิตสามารถจับกับตัวรับโฮโมโลกัสของเซลล์ภูมิคุ้มกันและปลายประสาทเวกัส ทำให้การสื่อสารระหว่างสมองและลำไส้สมบูรณ์ (Tan et al., 2022)
ความผิดปกติของจุลินทรีย์ในลำไส้อาจมีส่วนร่วมในความก้าวหน้าของ PCOS ผ่านแกนสมอง-ลำไส้ (Zhao et al., 2020) แบคทีเรียในลำไส้สามารถผลิต SCFA ซึ่งเกี่ยวข้องกับการหลั่งเปปไทด์ในลำไส้โดยเซลล์ต่อมไร้ท่อในลำไส้ เช่น เปปไทด์ที่คล้ายกับกลูคากอน 1, เปปไทด์ที่ปลดปล่อยฮอร์โมนการเจริญเติบโต (เกรลิน) และเปปไทด์ YY SCFA กระตุ้นโปรตีนเป้าหมาย/การถ่ายทอดสัญญาณของแรพามัยซินในสัตว์เลี้ยงลูกด้วยนม และวิถีสัญญาณตัวกระตุ้นการถอดรหัสผ่านตัวรับ G-protein coupled receptor 43 และควบคุมการแสดงออกของเปปไทด์ในลำไส้ (Zuo et al., 2022)
เปปไทด์ในลำไส้ (เช่น เกรลิน) สามารถมีส่วนร่วมในการควบคุมนิวเคลียสควบคุมไฮโปทาลามัสและการหลั่งฮอร์โมนลูทีไนซิ่ง เกรลินยังสามารถยับยั้งการสังเคราะห์และการปล่อยฮอร์โมนลูทีไนซิ่งที่มากเกินไปโดยการชะลอความเข้มข้นของพัลส์ของฮอร์โมนลูทีไนซิ่งที่หลั่งจากต่อมใต้สมอง จึงมีส่วนร่วมในการควบคุมการทำงานของระบบสืบพันธุ์ของ PCOS (Hoover et al., 2021) การรักษา PCOS โดยอาศัยจุลินทรีย์ในลำไส้
โปรไบโอติกส์และพรีไบโอติกส์(ซินไบโอติกส์)
ในช่วงไม่กี่ปีที่ผ่านมา ด้วยความเข้าใจอย่างต่อเนื่องเกี่ยวกับจุลินทรีย์ในลำไส้ การใช้จุลินทรีย์ในการรักษา PCOS จึงได้รับความสนใจอย่างกว้างขวาง (Zhao et al., 2021) มีหลักฐานมากขึ้นเรื่อยๆ แสดงให้เห็นว่าโปรไบโอติกส์ พรีไบโอติกส์ หรือซินไบโอติกส์ เป็นทางเลือกการรักษาที่มีประสิทธิภาพสำหรับผู้ป่วย PCOS (Miao et al., 2021) การศึกษาแสดงให้เห็นว่าโปรไบโอติกส์สามารถฟื้นฟูความหลากหลายของจุลินทรีย์ในลำไส้ของหนู PCOS ปรับปรุงความผิดปกติของจุลินทรีย์ในลำไส้ และปรับปรุงการทำงานของระบบสืบพันธุ์ของหนู (Li T. et al., 2022) ในทางกลับกัน จากการศึกษาในมนุษย์ ผู้ป่วย PCOS จำนวน 60 ราย ถูกสุ่มแบ่งออกเป็นสองกลุ่ม และได้รับอาหารเสริมโปรไบโอติกส์ (bifidobacteria, lactic acid bacteria ฯลฯ) และการทดสอบควบคุมด้วยยาหลอก หลังจาก 12 สัปดาห์ พบว่าโปรตีนที่จับกับฮอร์โมนเพศในกลุ่มทดสอบเพิ่มขึ้น คะแนนขนดกลดลง R ความไวต่ออินซูลินเพิ่มขึ้น และระดับไลโปโปรตีนลดลง ซึ่งบ่งชี้ว่าการรักษาด้วยโปรไบโอติกแบบแทรกแซงมีผลในระดับหนึ่งต่อผู้ป่วย PCOS ในแบบจำลองการควบคุมอาหารของหนูที่เป็นโรคเบาหวานและโรคอ้วน พบว่าสายพันธุ์ B. lactis B420 ช่วยปรับปรุงภาวะดื้อต่ออินซูลินและลดปริมาณไขมัน (Yde et al., 2021)
จากการศึกษาทางคลินิกพบว่าการใช้ B. lactis สามารถปรับปรุงระดับฮอร์โมนเพศของผู้ป่วย PCOS ได้ โปรไบโอติกอาจกลายเป็นวิธีการสำคัญในการแทรกแซงภาวะอ้วนจาก PCOS ในอนาคต ในการศึกษาความสัมพันธ์แบบดั้งเดิม ความสัมพันธ์ระหว่างจุลินทรีย์ในลำไส้และโรคได้รับการศึกษาจากมุมมองมหภาค ในช่วงไม่กี่ปีที่ผ่านมา ในการศึกษาเกี่ยวกับจุลินทรีย์ในลำไส้บางกรณี โดยการระบุสายพันธุ์ที่แตกต่างกันและดำเนินการวิจัยอย่างละเอียดในระดับสายพันธุ์เฉพาะ วิธีการวิจัยประเภทนี้สมควรได้รับความสนใจ
ดังนั้นถ้าคุณมีภาวะ ถุงน้ำรังไข่หลายใบ ผลิตภัณฑ์อาหารเสริมที่ควรเพิ่มเข้าไป ก็คือ
Synbc
Mildy v
และนี่คือลิงค์เก่าของ PCOS
ด้วยรักและห่วงใยจากใจจริง
ค้นหาสินค้า
หมวดหมู่สินค้า
ระบบสมาชิก
คุณเป็นตัวแทนจำหน่าย
- ระดับ{{userdata.dropship_level_name}}
- ไปหน้าหลักตัวแทน
ระดับสมาชิกของคุณ ที่ร้านค้านี้
รายการสั่งซื้อของฉัน
- ทั้งหมด {{(order_nums && order_nums.all)?'('+order_nums.all+')':''}}
- รอการชำระเงิน {{(order_nums && order_nums.wait_payment)?'('+order_nums.wait_payment+')':''}}
- รอตรวจสอบยอดเงิน {{(order_nums && order_nums.wait_payment_verify)?'('+order_nums.wait_payment_verify+')':''}}
- รอจัดส่งสินค้า {{(order_nums && order_nums.wait_send)?'('+order_nums.wait_send+')':''}}
- รอยืนยันได้รับสินค้า {{(order_nums && (order_nums.wait_receive || order_nums.wait_confirm))?'('+(order_nums.wait_receive+order_nums.wait_confirm)+')':''}}
- รอตรวจสอบข้อร้องเรียน {{(order_nums && order_nums.dispute)?'('+order_nums.dispute+')':''}}
- เรียบร้อยแล้ว {{(order_nums && order_nums.completed)?'('+order_nums.completed+')':''}}
- ทั้งหมด {{(order_nums && order_nums.all)?'('+order_nums.all+')':''}}
- รอการชำระเงิน {{(order_nums && order_nums.wait_payment)?'('+order_nums.wait_payment+')':''}}
- รอตรวจสอบยอดเงิน{{(order_nums && order_nums.wait_payment_verify)?'('+order_nums.wait_payment_verify+')':''}}
- รอจัดส่งสินค้า {{(order_nums && order_nums.wait_send)?'('+order_nums.wait_send+')':''}}
- ส่งสินค้าเรียบร้อยแล้ว {{(order_nums && order_nums.sent)?'('+order_nums.sent+')':''}}
ติดต่อเรา
0971654697
ติดตามสินค้า
เว็บเพื่อนบ้าน
หน้าแรก | วิธีการสั่งซื้อสินค้า | แจ้งชำระเงิน | บทความ | เว็บบอร์ด | เกี่ยวกับเรา | ติดต่อเรา | ตะกร้าสินค้า | Site Map
ร้านค้าออนไลน์
Inspired by
LnwShop.com (v2)
▲
▼
รายการสั่งซื้อของฉัน
รายการสั่งซื้อของฉัน
ข้อมูลร้านค้านี้

SANTI MANADEE
ไม่เอาภาระเข้าร่างกาย เอาสิ่งดี ๆ ใส่ให้กับร่างกาย คุณก็จะมีสุขภาพดี
เบอร์โทร : 0971654697
อีเมล :
อีเมล :
ส่งข้อความติดต่อร้าน
เกี่ยวกับร้านค้านี้
ค้นหาสินค้าในร้านนี้
ค้นหาสินค้า
สินค้าที่ดูล่าสุด
บันทึกเป็นร้านโปรด
Join เป็นสมาชิกร้าน
แชร์หน้านี้
แชร์หน้านี้
↑
TOP เลื่อนขึ้นบนสุด
TOP เลื่อนขึ้นบนสุด
คุณมีสินค้า 0 ชิ้นในตะกร้า สั่งซื้อทันที
สินค้าในตะกร้า ({{total_num}} รายการ)

ขออภัย ขณะนี้ยังไม่มีสินค้าในตะกร้า
ราคาสินค้าทั้งหมด
฿ {{price_format(total_price)}}
- ฿ {{price_format(discount.price)}}
ราคาสินค้าทั้งหมด
{{total_quantity}} ชิ้น
฿ {{price_format(after_product_price)}}
ราคาไม่รวมค่าจัดส่ง
➜ เลือกซื้อสินค้าเพิ่ม



